自2024年1月起,由国家市场监督管理总局、海关总署及农业农村部发布的多项法规、标准即将实施。其中,国家市场监督管理总局发布的《特殊医学用途配方食品注册管理办法》,于2024年1月1日正式实施。为了更好的帮助企业了解重要法规情况,中食安信对相关内容进行了简单解读,供大家参考。
2023年11月28日国家市场监督管理总局修订发布了《特殊医学用途配方食品注册管理办法》(以下称《办法》)。进一步完善特殊医学用途配方食品(以下简称“特医食品”)注册管理要求,从而保证产品质量安全。该《办法》对拟在中国境内生产并销售特医食品和拟向中国出口特医食品的境外生产企业,从申请条件、注册程序、临床试验、标签与说明书、监督管理、法律责任等方面作出规定。以下总结了修订后《办法》中的重点变化。
01
制定优先审评审批程序,优化注册流程
修订后的《办法》制定了优先审评审批程序,将罕见病、临床急需新类型特医食品纳入优先审评审批程序,引导鼓励企业研发临床急需产品,满足临床病患需要。并将纳入优先审评审批程序的产品,审评时限由最多的90个工作日缩短到30个工作日。在特定全营养配方食品在临床试验现场核查时限上进行了压缩,由40个工作日压缩至30个工作日,提高了审评时效。
修订后的《办法》优化了注册中的现场核查流程,给予企业30个工作日反馈是否接受现场核查,并明确具体核查时间,兼顾核查准备和工作时效。
02
严格注册要求,明确不予注册的情形
修订后的《办法》明确了不予注册的7种情形。分别为:(一)申请材料弄虚作假、不真实的;(二)申请材料不支持产品安全性、营养充足性以及特殊医学用途临床效果的;(三)申请人不具备与所申请注册产品相适应的研发能力、生产能力或者检验能力的;(四)申请人未在规定时限内提交补正材料,或者提交的补正材料不符合要求的;(五)逾期不能确认现场核查日期,拒绝或者不配合现场核查、抽样检验的;(六)现场核查报告结论或者样品检验报告结论为不符合注册要求的;(七)其他不符合法律、法规、规章、食品安全国家标准和技术要求等注册要求的情形。
同时,还明确要求不予注册通知要给出不予注册的理由。现场核查内容的要求也进行了细化,并规定在注册证书中增加“产品其他技术要求”项目,进一步保障产品质量安全有效。此外,在违规行为的处置力度上也进行了加严加大。
03
进一步明确产品标签、说明书标示要求,保护消费者权益
修订后的《办法》对标签、说明书标示要求也进行了进一步的严格,该要求与《特殊医学用途配方食品标识指南》以及GB 29922《食品安全国家标准 特殊医学用途配方食品通则》的要求相结合,明确标签的主要展示版面标注内容;要求对产品的配方特点或营养学特征进行描述;体现特医食品产品属性;在标签、说明书上提示消费者“请在医生或临床营养师指导下使用”和警示用语,指导消费者正确使用;明确不得对产品中的营养素及其他成分进行功能声称,避免误导消费者。
04
对变更注册和延续注册的要求进行了调整
变更注册需要提交产品变更论证报告,明确食品原料和食品添加剂品种不变、配料表顺序不变、营养成分表不变,使用量在一定范围内合理波动或者调整的,不需要申请变更注册。
延续注册需要提交企业研发能力、生产能力、检验能力情况,产品安全性、营养充足性和特殊医学临床效果方面的跟踪评价情况等材料;要求省级食品安全监督管理部门出具延续注册意见书。对于申请人未能保持研发能力、生产能力、检验能力的不予延续注册。
除上述法规外,中食安信还梳理汇总了1月正式实施的食品及饲料相关法规、国家标准等法规标准。详细内容请见附件。
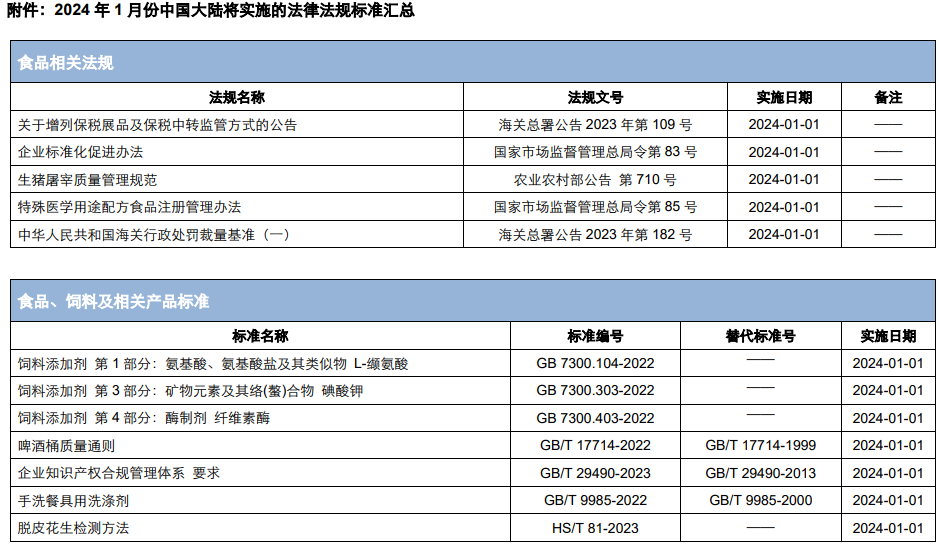
来源:中食安信
中食安信是一家专业服务于食品行业的法规咨询机构,致力于为全球食品行业客户提供食品标准法规咨询、食品相关报批注册、食品合规管理系统、食品行业信息服务等全方位、全流程的食品合规管理咨询服务。
咨询电话:010-51301566












 京公网安备11010502045875
京公网安备11010502045875