母乳低聚糖(HMOs)是母乳中天然存在且特有的一类营养物质。HMOs对于婴幼儿有调节肠道菌群、预防和缓解肠道疾病、调节免疫系统、增强大脑功能等诸多益处。相关研究已经预测了母乳中可能存在上千种HMOs。目前已经报道的约有超过200种,已有多种HMOs产品已经在100余个国家和地区批准和/或上市。并且从文献研究来看,将HMOs应用于婴幼儿配方食品等食品是安全的(中国食品科技学会,2023)。母乳作为婴儿最理想的食物,母乳中的营养成分是婴幼儿配方食品研发时所需要考虑的重要因素。当少数乳母因患有疾病、乳汁分泌不足或无乳汁分泌等原因不能进行母乳喂养时,需要通过配方食品提供婴幼儿生长发育所需营养物质(中国食品科技学会,2022)。此外,综合目前对于HMOs功能的研究结果来看,HMOs对于成人的过敏性疾病的治疗有一定效果,且在促进益生菌增殖、降低病原体感染、降低炎症因子水平方面,对于成人均有相同的效果。并且有研究证明,HMOs对于成人也是安全且耐受的。因此,其应用范围还可以扩展到特殊医学用途配方食品以及普通食品中(史玉东 等,2020)。本文中,中食安信将对国内外HMOs的审批应用情况进行分析,并结合目前中国的批准情况,协助企业找到未来的申报思路。
今年10月,国家卫生健康委员会(以下简称“国家卫健委”)发布了2023年第8号公告《关于桃胶等15种“三新食品”的公告》。其中批准了3种不同生产菌来源的2’-岩藻糖基乳糖,以及1种乳糖-N-新四糖应用于调制乳粉(仅限儿童用乳粉)、婴儿配方食品、较大婴儿和幼儿配方食品、以及特殊医学用途婴儿配方食品中。根据国家卫健委网站公示的受理情况,目前还有其他生产菌生产的2’-岩藻糖基乳糖(2’-fucosyllactose;2’-FL)、3-岩藻糖基乳糖(3-fucosyllactose;3-FL)、3’-唾液乳糖钠盐(3’-sialyllactose sodium salt;3’-SL)、6’-唾液酸乳糖钠盐(6'-sialyllactose sodium salt;6’-SL)、乳糖-N-新四糖(Lacto-N-neotetraose;LNnT)申报的食品添加剂新品种被受理。
然而相比于中国,在其他国家和地区已经批准使用的HMOs的产品品种要远多于中国。目前已经在国外批准上市使用的有8种,分别为2’-岩藻糖基乳糖、乳糖-N-新四糖、3-岩藻糖基乳糖、3’-唾液酸基乳糖钠盐、6’-唾液酸基乳糖钠盐、乳糖-N-四糖(Lacto-N-tetraose;LNT)、2’-岩藻糖基乳糖/二岩藻糖基乳糖(2’- fucosyllactose and difucosyllactose;2’-FL/DFL)以及乳糖-N-岩藻糖五糖/2’-岩藻糖基乳糖(Lacto-N-fucopentaose I with 2’-fucosyllactose;LNFP-I/2’-FL)。以下图表中梳理了中国大陆、中国台湾、美国、欧盟、澳新(澳大利亚和新西兰)、加拿大这几个重点国家或地区对于HMOs的批准情况。
表1:HMOs在重点国家(地区)批准的种类及总体个数
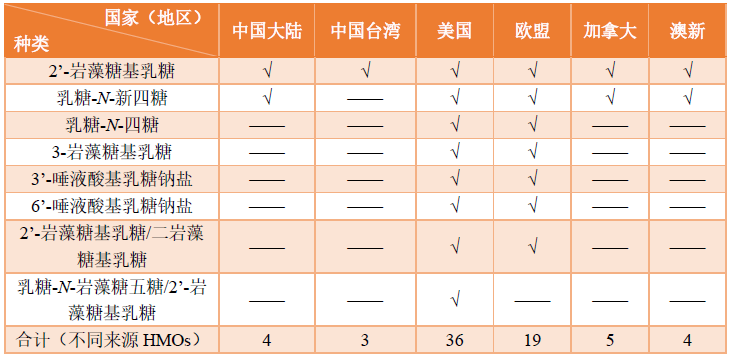
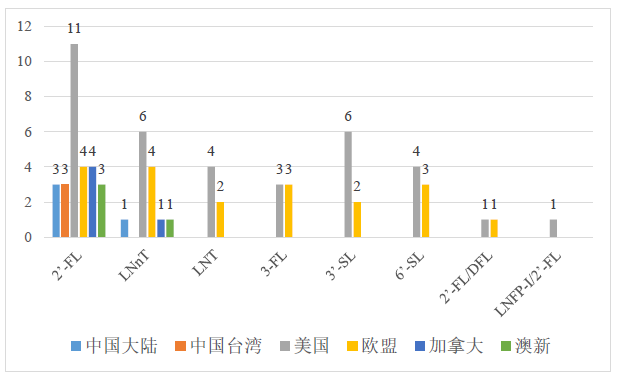
图1:各类HMOs在各重点国家(地区)的批准个数
在产品的使用范围方面,以美国和欧盟为例,仅2’-岩藻糖基乳糖批准使用的食品类别就远多于中国,除了此次中国批准的儿童用调制乳粉、婴幼儿配方食品以及特殊医学用途婴儿配方食品之外,还可以用于婴幼儿谷类食品,婴幼儿使用的乳基饮料、食品补充剂、饮料(例如,果汁、乳饮料、运动能量饮料);乳制品(例如:酸奶、调制乳);早餐谷物;代餐棒;果冻等各类食品中。此外,许多其他种类的HMOs也有被批准使用于各类普通食品中。并且从欧盟对于HMOs的管理情况来看,2’-岩藻糖基乳糖的使用范围在不断修订,未来可能会批准将其应用于更多食品类别中。
综上所述,在其他国家和地区,HMOs被批准的种类多于目前中国批准的种类,使用范围也更为广泛。目前在中国,根据卫健委网站公布的申报受理信息显示,还有其他企业正在申报除2’-岩藻糖基乳糖和乳糖-N-新四糖外的其他HMOs作为食品添加剂新品种(食品营养强化剂)应用于食品中,但目前并未公开征求意见,也并未公开是否有产品申请将其应用于更多的食品类别中。
然而,HMOs产品的合规使用目前也面临着几项考验:
1. 产品国产化
目前批准的产品多为进口产品,但因国际关系、技术“卡脖子”、产品垄断市场、供应链安全等问题,我国需要鼓励国内企业自主研发HMOs,拥有属于自己的国产HMOs,打破国际壁垒,避免出现原料断供等情况。
2. 产品合规使用
目前生产HMOs产品的方式多为使用转基因菌株进行发酵来实现高效及稳定的产能。转基因菌株发酵生产的食品添加剂新品种的申报相较于其他的食品添加剂,在流程上要相对复杂。在我国,这一类型的食品添加剂需要分两步进行评审:
1)由农业农村部进行转基因微生物的安全性评价
2)由国家卫健委进行食品添加剂新品种的审评
首先,我国目前对于转基因微生物的批准和使用有着严格的要求,需要企业依据相关法规要求准备安全性评价材料。最终由农业农村部对材料进行安全性评价,通过后才可以进行后续的食品添加剂新品种的申报。
食品添加剂新品种的申报部分需要按照《食品添加剂新品种管理办法》等要求准备材料,并将材料提交至国家卫健委,由国家卫健委按照相应的办理流程进行审批,审批通过后产品才可以进行合规使用。
一个由转基因菌株发酵生产的HMOs的合规使用大约需要2~3年的时间,安全性评价和申报部分的材料准备较为复杂,内容也较多,需要对申报材料的内容要求进行细致研究并进行反复斟酌和详细撰写,从而确保符合农业农村部及国家卫健委的要求。因此,产品的合规评审是企业未来合规使用HMOs的重要环节。
3. 不同产品的使用范围,使用量及质量规格的设定
当前中国只有2’-岩藻糖基乳糖和乳糖-N-新四糖批准应用于儿童用调制乳粉、婴幼儿配方食品以及特殊医学用途婴儿配方食品中,2’-岩藻糖基乳糖的使用量为0.7~2.4g/L,乳糖-N-新四糖的使用量为0.2~0.6g/L。并且在公告中还规定了相应的质量规格。这两项产品已经经过了专家组审评以及社会风险评估,正式批准使用,几乎可以作为行业的统一标准。
但其他种类的HMOs产品的使用范围,使用量及质量规格目前还没有公开征求意见,企业在制定相应的要求时没有官方公告标准进行参考。基于这种情况,企业通常会参考其他国家及地区的批准情况来进行制定及申报。但各国的母乳中HMOs的含量不同,且应用人群的生长环境和需求不同,因此其他国家或地区的批准情况并不能作为制定产品使用范围、使用量,以及质量规格的唯一参考依据,还是需要结合我国母乳中该营养物质的含量,以及应用人群的需求进行综合考量来确定。
总之,HMOs的营养必要性、安全性与应用可行性在中国已经得到了广泛认可,但如何将产品合规化、未来如何合规使用是目前行业所需要关注的重点。希望以上内容,可以更好的帮助企业找到未来在合规申报的思路。
参考文献:
1. 史玉东,刘梦瑶,卢卫红.母乳低聚糖的结构与功能研究进展[J].食品安全质量检测学报,2020,11(21):7656-7662.
2. 中国食品科学技术学会. 母乳低聚糖(HMOs)的科学共识[J]. 中国食品学报,2023,23(6):452-457.
3. 中国食品科学技术学会食品营养与健康分会.母乳科学与婴幼儿配方食品制造技术六大研究热点[J/OL].中国食品学报,2022,22(12):413-419.
来源:中食安信
中食安信是一家专业服务于食品行业的法规咨询机构,致力于为全球食品行业客户提供食品标准法规咨询、食品相关报批注册、食品合规管理系统、食品行业信息服务等全方位、全流程的食品合规管理咨询服务。
咨询电话:010-51301566












 京公网安备11010502045875
京公网安备11010502045875