继7月5日中保办开通特医食品网上申报系统后,CFDA终于在历经3个月的征求意见后于7月14日晚正式公告《特殊医学用途配方食品注册管理办法》相关配套文件,包括《注册申请材料项目与要求(试行)》(以下简称附件1)、《标签、说明书样稿要求(试行)》(以下简称附件2)、《稳定性研究要求(试行)》(以下简称附件3)和《注册生产企业现场核查要点及判断原则(试行)》(以下简称附件4)。稍显遗憾的是《临床试验质量管理规范》此次未同时发布,有些企业的注册准备工作仍然有些无从下手。笔者整理了上述4个文件中的12个关键点,在此分享大家,共同探讨。
1.抢名大战一触即发
附件1中规定:产品的商品名称不得与已经批准的药品、保健食品及特殊医学用途配方食品名称相同。这或许是CFDA从保健食品吸取的教训,比如笔者在CFDA官网输入“破壁灵芝孢子粉”,显示批准的保健食品98条之多,势必令消费者眼花缭乱。特医食品杜绝同名产品,有利于规范市场。
目前国家还未批准过特医食品,一个好的产品名称抢先批准,无疑将对占领市场至关重要,而对于后来的企业,产品名称或许会成为技术难题。
2.包装材料和规格不能随意变更
附件1研发报告中较征求意见稿增加“包装材料名称和质量要求”,同时表述:分析稳定性考察结果与产品包装材料之间的关系,包装材料和产品包装规格应与拟上市产品一致。
该规定表明CFDA将更强调包装材料、规格对于产品稳定性的影响,产品批准上市后将不能随意更改包装材料、规格。
3.允许共线生产
附件1生产工艺处规定:“不同品种的产品在同一条生产线上生产时,提供有效防止交叉污染所采取的措施及相关材料”。附件4生产条件考核项中规定:“生产企业的生产车间、生产设施和设备应当满足生产要求;存在引起食物蛋白过敏等食品安全风险的产品,不得与非特殊医学用途配方食品共线生产。”而此处征求意见稿时表述:“生产企业应当采用专用和独立的生产车间、生产设施和设备,满足预定生产;与其他非特殊医学用途配方食品不共线生产。”
这表明,CFDA已不硬性要求生产企业专用和独立的生产车间、设施和设备,允许特医食品不同品种共线生产,但如何对共线生产时存在的潜在风险进行评估管理,杜绝交叉污染带来的危害、混淆带来的危害和人为差错带来的危害,将是审评时的重中之重。
4.中试条件要求大幅提升
附件1规定,对于试验样品要在商业化生产条件下生产,废弃了征求意见稿中提出的批量达到中试及以上规模条件。
该条含义即要求申报企业在申报时就具备了大生产条件,一次到位。无疑这大大提高了准入企业的门槛,未来大企业的技术和研发优势会表现得更明显。
5.或不再要求企业全检能力
对于是否要求企业具备全检能力,此次的4个文件未做明确表述,但附件1中表述:申请人具备全部项目逐批检验能力的相关证明材料,如检验机构相关资质证明文件、检验仪器清单及相关检验报告。附件2中删除了此前征求意见稿中“稳定性考察项目由申请人自行检测”的表述。附件4检验部门考核项中也删除了“申请人应当设立独立的检验部门”的规定。
这是否暗示申报企业可以委托有全检能力的检验机构进行逐批检验?否则为何提供“检验机构相关资质证明文件”?
6.抽样检验可以规避
《特医食品注册管理办法》第十三条规定:审评机构应当委托具有法定资质的食品检验机构进行抽样检验;检验机构应当自接受委托之日起30个工作日内完成抽样检验。而此次公布的附件1中规定:三批试验样品检验报告由具有法定资质的食品检验机构出具的,注册审评过程中食品审评机构不再委托相关机构进行抽样检验。
据此,国医健食建议申报企业在检验机构进行试验样品检验,如此会很大缩短产品申报周期,减少企业成本。这点必须为CFDA点赞,为何保健食品的评审不学习下呢?
7.延续程序获得简化
有关特医食品延续,相较于此前的征求意见稿,此次的配套文件去掉了“省级食品药品监督管理部门出具的日常监管情况及有关延续注册意见”以及“经备案的食品安全企业标准”。这大大简化了程序,减少企业办理延续难度。但在产品跟踪评价情况上,要求则更加具体:“五年内产品生产、销售、抽验情况总结,对产品不合格情况的说明,以及五年内产品临床使用情况及不良反应情况总结等。”
这表明CFDA更加强调企业对产品质量安全负责的主体责任。
8.稳定性研究影响因素试验不可少
附件中规定:产品应当进行影响因素试验、加速试验和长期试验。相较于征求意见稿,法规正式将影响因素试验(高温、高湿、光照)列入必检项目,向药品靠拢。影响因素试验、开启后使用的稳定性试验等采用一批样品进行,加速试验和长期试验分别采用三批样品进行。
9.加速试验结束后即可注册
附件2中规定:加速试验考察时间为产品保质期的四分之一,且不得少于3个月;长期稳定性试验与加速试验应同时开始,申请人可在加速试验结束后提出注册申请,并承诺按规定继续完成长期稳定性试验。而此前征求意见稿中表述“长期稳定性试验可在第9个月或以上考察点结束后提出注册申请”。
法规的这点调整无疑将更利于企业尽快申报,使产品尽快上市。
10.不再要求进口产品已上市
附件1规定:申请进口特殊医学用途配方食品注册,提供产品在生产国家(地区)上市使用的说明书、包装、标签实样,附由中国境内公证机关公正的中文译本。如产品未经上市销售,可不提供,但需提供产品未经上市销售相关情况说明。
这表明CFDA并不要求进口产品已经在生产国(地区)上市,对于进口产品是一大利好。
11.接触产品用水必须纯化水
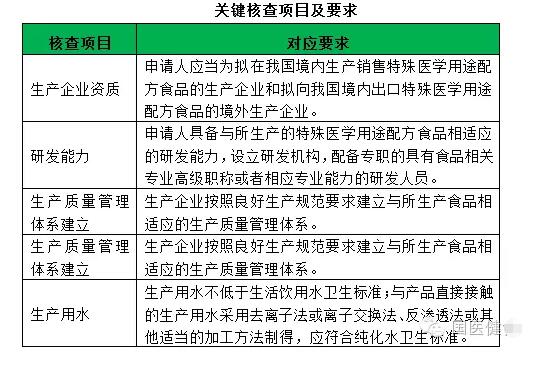
附件4生产用水核查项规定:生产用水不低于生活饮用水卫生标准;与产品直接接触的生产用水采用去离子法或离子交换法、反渗透法或其他适当的加工方法制得,应符合纯化水卫生标准。
众所周知,纯化水一般用于药品生产,其他用水应符合生活饮用水卫生标准。
12关键核查项目及要求
现场核查项目分为:生产能力、研发能力、检验能力、生产场所、设备设施、人员、物料管理、生产过程管理八个部分共24个核查项目,其中关键核查项目5个,分别为生产企业资质、研发能力、生产质量管理体系建立、生产条件、生产用水,其他为一般核查项目。
 京公网安备11010502045875
京公网安备11010502045875