市场监管总局关于发布《食品中匹可硫酸钠的测定》
食品补充检验方法的公告
(2019年第30号)
按照《食品补充检验方法工作规定》有关要求,《食品中匹可硫酸钠的测定》食品补充检验方法已经国家市场监督管理总局批准,现予发布。
特此公告。
附件:食品中匹可硫酸钠的测定
食品中匹可硫酸钠的测定
1.范围本标准规定了食品(含保健食品)中匹可硫酸钠的高效液相色谱-串联质谱联用测定方法。
本标准适用于果冻、蜜饯、糖果、饮料等食品(含与上述基质相同的保健食品及片剂、硬胶囊剂保健食品)中匹可硫酸钠的测定。
2.原理
试样粉碎后经水或甲醇溶液提取,必要时经聚酰胺净化后,经反相色谱柱分离,电喷雾离子源离子化,多反应离子监测检测,外标法定量。
3.试剂和材料
除另有规定,本方法所用试剂均为分析纯,水为 GB/T 6682规定的一级水。
3.1试剂
3.1.1乙腈(CH3CN):色谱纯。
3.1.2. 甲醇(CH3OH)。
3.1.3. 无水乙醇(CH3CH3OH)。
3.1.4. 氨水(NH3H2O):浓度25%~28%。
3.1.5. 乙酸铵(CH3COONH4):色谱纯。
3.1.6. 三氯乙酸(C2HCl3O2)。
3.1.7.聚酰胺固相萃取柱:取 1g聚酰胺粉(层析用, 200目),用 10mL水活化,并装填于带有适量脱脂棉花的 10mL一次性注射器中。亦可采用商品化固相萃取小柱(1000mg,6cc),使用前用水活化,或按商品说明书进行活化操作。
3.2.试剂配制
3.2.1.三氯乙酸溶液( 1%):称取 10g三氯乙酸( 3.1.6),加 1000mL水溶解。
3.2.2. 70%甲醇溶液:量取 700mL甲醇( 3.1.2),加水定容至 1000mL。
3.2.3.无水乙醇 -氨水 -水溶液( 7+1+2,体积比):量取 100 mL氨水(3.1.4),700mL无水乙醇(3.1.3),水 200mL,混匀。
3.2.4.乙酸铵溶液( 10mmol/L):称取 0.77g乙酸铵( 3.1.5),加入 1000mL水溶解,经 0.22μm水相微孔滤膜过滤后备用。
3.3.标准品:匹可硫酸钠,其中文名称、英文名称、 CAS号、分子式、相对分子质量、结构式见附录 A。
3.4.标准溶液配制
3.4.1.标准储备液( 1000mg/L):准确称取匹可硫酸钠标准品 10mg(精确至 0.00001g),置于 10mL容量瓶中,加水溶解并稀释至刻度,摇匀,制成浓度为 1000mg/L标准储备液, 4℃避光保存,有效期 1个月。
3.4.2.标准使用液( 5mg/L):取标准储备液( 3.4.1)1mL于 200mL容量瓶中,用水稀释至刻度,摇匀,制成浓度为 5mg/L的标准使用液, 4℃避光保存,有效期 7天。
3.4.3.标准系列工作溶液:准确量取标准使用液( 3.4.2)适量,用水配制成质量浓度为 5ng/mL、10ng/mL、50ng/mL、100ng/mL、 250ng/mL、500ng/mL,或依仪器响应和实际情况配制适当浓度的标准系列工作溶液。
3.5. 材料
3.5.1. 微孔滤膜:0.22μm,PES滤膜和PTFE滤膜。
4. 仪器与设备
4.1. 液相色谱-三重四极杆串联质谱仪,配电喷雾(ESI)离
子源。
4.2. 分析天平:感量分别为0.0001g和0.00001g
4.3. 超声波水浴。
4.4. 恒温水浴锅。
4.5. 固相萃取装置。
5. 试样制备
5.1. 果冻、蜜饯、糖果、固体饮料、片剂、硬胶囊剂
取适量代表性样品(硬胶囊剂取内容物),采用捣碎、剪碎或
研碎等方式混匀,装入洁净容器中,密封并标记。
5.2. 液体饮料
充分混匀,直接取用。
6.分析步骤
6.1试样提取
6.1.1果冻
称取 1g(精确到 0.001g)试样于 50mL离心管中,加入 20mL水, 80℃水浴至胶质溶散,水浴过程中注意摇散,提取液转移至 25mL容量瓶中,加入 2.5mL三氯乙酸溶液( 3.2.1),用水定容至 25mL,待净化。若提取液浑浊,可取适量 8000r/min离心 5min,上清液待净化。
6.1.2.蜜饯
称取 1g(精确到 0.001g)试样于 50mL离心管中,准确加入 40mL水,超声提取 15min,8000r/min离心 5min,上清液转移至 50mL容量瓶中,用 5mL水洗涤残渣,洗涤液并入同一容量瓶,加入 5mL三氯乙酸溶液(3.2.1),用水定容至 50mL,待净化。
6.1.3糖果
6.1.3.1压片糖果
称取 0.5g(精确到 0.0001g)试样于 50mL离心管中,准确加入 10mL70%甲醇溶液( 3.2.2),涡旋 30s,超声提取 30min,8000r/min离心 5min。取上清液 1mL于 5mL容量瓶中,用水稀释至刻度,摇匀,过 PTFE微孔滤膜,待测。可根据实际浓度用水适当稀释至线性范围内,供液相色谱-质谱联用仪分析。
6.1.3.2其他糖果
称取 1g(精确到 0.001g)试样于小烧杯中,加入 40mL水, 80℃ 水浴至样品溶解(胶基糖果水浴 15min,水浴过程中注意摇散),转移至 50mL容量瓶中,用 5mL水洗涤烧杯,洗涤液并入同一容量瓶,加入 5mL三氯乙酸溶液( 3.2.1),用水定容至 50mL,待净化。若提取液浑浊,可取适量 8000r/min离心 5min,上清液待净化。
6.1.4.固体饮料
称取 1g(精确到 0.001g)试样于 50mL离心管中,加入 25mL水, 80℃水浴 10min,8000r/min离心 5min,收集提取液,加入 20mL水洗涤残渣,涡旋 30s,8000r/min离心 5min,合并两次提取液,于提取液中加入 5mL三氯乙酸溶液( 3.2.1),用水定容至 50mL。若提取液浑浊,可取适量 8000r/min离心 5min,上清液待净化。
6.1.5.液体饮料
称取 1g(精确到 0.001g)试样于 25mL具塞比色管中,加入 20mL水, 80℃水浴 10min,放冷后加入 2.5mL三氯乙酸溶液(3.2.1),用水定容至 25mL。若提取液浑浊,可取适量 8000r/min离心 5min,上清液待净化。
6.1.6片剂、硬胶囊剂
同“6.1.3.1压片糖果”。
6.2试样净化
6.2.1果冻、液体饮料
取 10mL待净化液至已活化的聚酰胺固相萃取柱( 3.1.7)内,待溶液流尽后,依次用 10mL水、 15mL70%甲醇溶液( 3.2.2)洗涤, 20mL无水乙醇 -氨水 -水溶液( 3.2.3)洗脱,收集洗脱液于 80℃水 浴上蒸发至近干,用水定容至 10mL,过 0.22μmPES或 PTFE滤膜,待测。可根据实际浓度用水适当稀释至线性范围内,供液相色谱-质谱联用仪分析。
6.2.2.蜜饯、其他糖果、固体饮料
净化操作同 “5.2.1果冻、蜜饯、液体饮料”,洗脱液于 80℃水浴上蒸发至近干,用水定容至 5mL,过 0.22μmPES或 PTFE滤膜,待测。可根据实际浓度用水适当稀释至线性范围内,供液相色谱 ¬质谱联用仪分析。
6.3空白试样称取空白试样适量,与试样同法处理,制得空白基质溶液。
6.4仪器参考条件
6.4.1色谱条件
6.4.1.1.色谱柱: C18柱, 2.1mm×100mm,2.6μm,或同等性能的色谱柱。
6.4.1.2.流动相: 10mmol/L乙酸铵溶液+乙腈(85+15)。
6.4.1.3.流速: 0.3mL/min。
6.4.1.4.柱温: 35℃。
6.4.1.5.进样量: 5μL。
6.4.2.质谱条件
6.4.2.1.离子源:电喷雾离子源(ESI)。
6.4.2.2.扫描方式:正离子扫描。
6.4.2.3.检测方式:多反应模式(MRM)。
6.4.2.4.干燥气、雾化气、鞘气、碰撞气等均为高纯氮气或其他合适气体,使用前应调节相应参数使质谱灵敏度达到检测要求,喷雾电压、离子源温度、干燥气温度、鞘气温度、鞘气流量等参数应优化至最佳灵敏度。
6.4.2.5参考监测离子对和参考参数表 1匹可硫酸钠定性、定量离子和质谱分析参数参考值
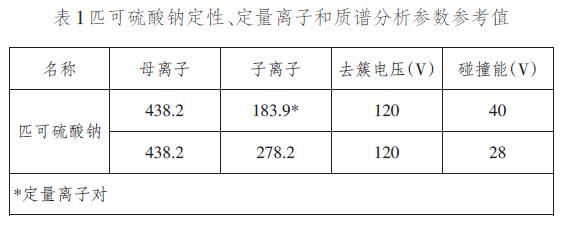
6.5试样测定
将标准系列工作溶液和试样溶液分别注入高效液相色谱 -质谱联用仪中测定。根据保留时间和相对离子对丰度比定性,外标峰面积定量。
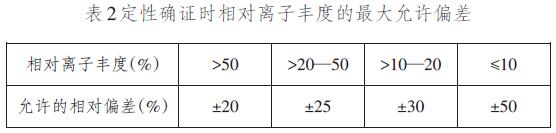
7.空白试验
除不加试样外,均按试样同法处理。
8.结果计算
试样中匹可硫酸钠的含量按下式计算:
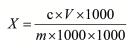
式中: X-食品中匹可硫酸钠(以 C18H13NNa2O8S2H2O计)的含量, mg/ kg;
c-试品溶液中匹可硫酸钠(以 C18H13NNa2O8S2H2O计)的浓度, ng/mLV-;
v-试品稀释液体积, mL;
1000-单位换算;
m-试品质量, g。
9.检测方法的灵敏度、精密度、专属性
9.1灵敏度
果冻、蜜饯、其他糖果、饮料取样量为 1g,稀释倍数为 25时,定量限为 0.125mg/kg,检出限为 0.05mg/kg;压片糖果、片剂、硬胶囊剂取样量为 0.5g,稀释倍数为 50时,定量限为 0.5mg/kg,检出限为 0.2mg/kg。
9.2.精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的 15%。
9.3.专属性空白试验应无干扰。
 京公网安备11010502045875
京公网安备11010502045875